|
|
[回上頁 | 顯示此文件為可列印格式]
此文件提供者: shuYing - [評分 : 0.00 (0 票選) | 評分!]
Q熱與生物安全防疫
邱慧英 龐飛
國立台灣大學獸醫專業學院
一、Q熱名稱的由來:
Q熱病原是伯納特科克斯氏體(Coxiella burnetii),可感染人與動物的人畜共通傳染病,又稱為Coxiellosis。本病於1935年最先發生於澳洲昆士蘭,因屠宰場工作人員出現典型肺炎,而稱為屠宰場熱(abattoir
fever),其後雖證實病原近似立克次體,但是對本病仍有許多疑問而改稱為Query fever (簡稱Q fever)。Q 熱病原的屬名與種名是為了紀念Herold
R. Cox及對於病毒學及免疫學有許多貢獻的澳大利亞諾貝爾獎得主Sir MacFarlane Burnet而命名。
二、Q熱的菌體特性
本菌呈多形性,細胞膜類似於革蘭氏陰性菌,可利用Giemsa、Macchiavello’s或Ziehl-Neelsen染色。在電子顯微鏡下,其具有兩個細胞變異體(cell
variant),分別為大細胞變異體和小細胞變異體 (Large和small cell variant; LCV和SCV),擁有類似的外膜,LCV有大的周圍細胞質體空間和低電子密度,反之,SCV含有源自細胞膜的複雜內膜狀物及具高電子密度,小細胞變異形C.
burnetii會形成內孢子,對環境具有高度抵抗性,而能長期存在並污染環境。因C. burnetii不能合成ATP,必須依賴宿主細胞提供能量,在活細胞中才能生長繁衍,為絕對細胞內寄生菌,也因此,藥物難以作用於細胞吞噬小體(phagosomes)內的病原,治療效果通常不佳;其宿主通常為節肢動物和脊椎動物,但與Rickettsia屬不同的是它生長在寄主細胞的吞噬小體而非細胞質或細胞核中。在致病性方面C.
burnetii具有兩種抗原型,分別為phase 1與 phase 2,若抗體僅能與phase 2抗原作用,為一般Q熱;若抗體可同時與phase 1與
phase 2抗原作用,則為慢性Q熱,疾病與細胞壁上脂多醣(變異相)的抗原性改變有關。並且在急性型C. burnetii外膜蛋白的polypeptide抗原中具有immunodominant
的28-kDa蛋白,在慢性型則無此蛋白表現,因此可利用此區分急性Q熱或慢性Q熱。
三、Q熱如何傳播
C. burnetii可形成類似內孢子的構造,故能抵擋較強的物理與化學作用,對化學性消毒藥劑或高熱等均有耐受性,在惡劣環境中非常安定,甚至於4℃的低溫亦能存活,通常存在於尿液、糞便、廄肥、乳汁、家畜的胎盤組織與生產過程產生的分泌物中,其可長期安定的存在於環境與土壤中存活數月。Q
熱的傳播途徑主要是經由牛羊等動物的胎盤滋養細胞大量繁殖,1克胎盤組織具有109菌量,1毫升乳汁中含有105菌量(CDC-NIH
1993),因此,經由草食動物懷孕生產過程的體液、尿液、陰道分泌物、胎盤、羊水或乳汁等大量排菌,污染環境及可能接觸的動物、器械、人員等。環境中含有病原的飛沫或塵埃等經由空氣吸入而感染,並散播本病,且風可擴大本菌散播的距離與範圍,為動物與人最主要的感染途徑。其次為直接接觸及消化道感染,病原可經由血液、乳汁、糞便、排泄分泌物等傳染給人及其他畜禽。經由感染的壁蝨叮咬媒介傳染亦為可能的傳播途徑。貓也是一重要的帶原者,在人類健康及公共衛生上扮演重要角色。在澳洲,袋貍(bandicoot)是自然保菌者。許多種動物皆屬帶原者,包括鳥類如城市間的鴿子,空氣中的懸浮微粒與灰塵也是常見的感染源。本病尚可經由皮膚小傷口、眼結膜接觸等方式感染。由於本菌可耐乾燥且可長期殘存在環境中,人經由吸入而感染的病原數量可低於10個微生物(CDC-NIH
1993),而且,抵抗力差的敏感患者只要吸入、攝入或由黏膜途徑接觸一個病原,即可感染進而導致發病。在美國研究單位使用懷孕綿羊進行此疾病研究時發現,工作人員會因綿羊運輸路線感染本病。此外,其對環境的抵抗性強,迅速、容易由各種途徑擴散傳播本病,因此,亦為生物恐佈攻擊戰中重要的生物病原之一,在公共衛生上不可輕忽其重要性。
四、臨床症狀與病理學變化
-
動物:牛、綿羊、山羊等反芻獸感染時多呈不顯性感染,偶爾會出現輕微發熱、流產、羊感染會出現支氣管肺炎及粉紅眼,病原對乳房及胎盤具有高度親和性,因此會經由子宮排出物、胎盤、糞便和乳汁散佈病原。C.
burnetii可存在於血液、乳腺、上乳房淋巴結(supramammary lymph
nodes)、胎盤組織間及出現於生乳中而成為感染源。潛伏期不一,約9~28天(平均18~21天)。肉眼病變主要局限於胎盤組織,包括無明顯肉眼病變或嚴重壞死,胎盤變厚,多發性至融合的區域性鈣化等,在子葉間(intercotyledonary)區域出現大量黃白滲出物,若侵犯子葉(cotyledon),早期外圍出現白色環,中央區域散佈白色斑點。主要組織病變為急性全面性壞死性或化膿性胎盤炎,子葉絨毛(cotyledonary
villi)與子葉間(intercotyledonary)滋養細胞(trophoblast)細胞質中充滿嗜鹼性菌體,將細胞核壓擠於細胞邊緣,呈現圓胖肥大滋養細胞,經由Macchiavello’s
染色,C. burnetii菌體呈紫紅色紅染,間質結締組織疏鬆具有水腫液及少量炎症細胞浸潤。感染的胎兒通常沒有明顯病理學變化,偶可見肉芽腫性肝炎及非化膿性肺炎,並可見到淋巴球聚集於肺臟小支氣管周圍,肺泡間質組織間具有淋巴球及單核炎症細胞浸潤,有少量淋巴球及巨噬細胞浸潤腎臟髓質部及圍繞於肝門脈血管。發病後期於脾臟、肝臟門脈區域、脊髓、心臟、縱膈、腸繫膜脂肪組織間、胰臟、腎臟、腎上腺、膀胱粘膜、睪丸及腦會出現多發性類上皮巨噬細胞(epithelioid
macrophages)或多核巨大細胞(multinucleated giant cells)聚集形成肉芽腫性小結節。本病例需與Brucella、Campylobacter與Chlamydophila
等病原進行區別診斷。
-
人:人類病患在感染的病程及嚴重性等差異非常大,可發生無症狀之慢性感染及急性感染,或造成重發性系統性感染,通常臨床表癥以類似感冒症狀為主,或引起突發3~6天之弛張熱、畏寒、嚴重頭痛、咳嗽、間質性肺炎、胸痛、反胃、肌肉痛,有時出現脾臟及肝臟壓痛等,會產生肉芽腫性肝炎、肺炎、腦膜腦炎、睪丸炎、心肌炎、心內膜炎、腎炎等,吸入的病原會在肺臟增殖,並侵入血流而循環於所有臟器中,最後造成重發性系統性感染。人可以Tetracycline、Chloramphenicol與Aureomycin治療。
五、哪些人容易感染Q熱
只要與動物接觸密切的人員如獸醫師、畜主、牧場工作人員、屠宰場工作人員、皮毛製造業者、動物運送業者、實驗室檢驗人員或居住於污染區內的民眾皆為感染Q熱的高風險族群。日本曾針對獸醫師(n=267)進行Q熱盛行率調查,並以醫院工作者(n=352)及健康捐血者(n=2003)的樣本作為對照組進行評估與風險分析,結果獸醫師的Q熱陽性率為13.5%,遠高於一般健康捐血者(3.6%,
p < 0.001)及醫院工作者(5.1 %, p < 0.001),由此顯示日本獸醫及其他相關人員具有感染C. burnetii的高度風險。
六、保菌動物有哪些
自然界中,本病的宿主包括綿羊、山羊、
牛、野生動物、鳥類、人、犬、貓、袋貍、兔子、天竺鼠、黃金鼠及小鼠都可以感染本病或帶原,如鴿子或空氣中的懸浮微粒與灰塵等,病原可藉由皮膚小擦傷的傷口、眼結膜接觸等感染,扁蝨(tick)亦可能和傳播本疾病有關,對禽畜而言,本病通常呈不顯性感染,牛羊感染除流產率增加外,通常無明顯臨床症狀,病原可於巨噬細胞的吞噬小體中大量複製繁殖,由巨噬細胞帶到全身,透過血液、乳汁、糞便、排泄物或分泌物等排菌,並且對胎盤滋養細胞具有親和性,可在細胞質中大量複製後,藉由生產過程大量排菌污染環境,傳染給其他人、畜禽與動物。貓也是C.
burnetii的重要的帶原者,Randhawa et al. (1974)檢測加州南部地區207隻貓,發現抗體陽性率高達18.4%,Gillespie and
Baker
(1952)進行貓接種實驗,貓於皮下接種二天後持續三天出現沉鬱、厭食等,病原持續出現於血液中一個月、尿中二個月,因此寵物與人的伴侶關係中,帶原貓可能在人類健康上扮演重要角色。在澳洲,袋貍(bandicoot)則是主要的自然保菌動物。由於Q熱分布遍及全世界並交叉循環感染家畜、野生動物和壁蝨間,在家畜其可廣泛的循環感染包括綿羊、山羊、牛等草食動物、貓、狗和家禽等。
七、Q熱的檢測方法
若場內動物有不明的流產率增加時,可連絡轄區動物防疫單位或相關研究單位,協助診斷與疾病防治。診斷方法包括解剖及組織病理學診斷,病原核酸檢測,與血清學檢測等。
- 解剖及組織病理學檢查-
檢體必需包括胎盤組織或死亡的母羊,母羊需採取子宮等生殖道檢體,流產胎兒則需全身採樣,包括腦、肺臟、心臟、肝臟、腎臟、脾臟、胃、十二指腸、空腸、迴腸、盲腸、結腸等和其它必要之病材,固定於10%中性福馬林固定液中,經脫水、石蠟包埋後,製作成切片,以光學顯微鏡檢查,必要時進一步以組織化學染色法或免疫化學染色法進行鑑別診斷。
- 血清學檢查- 依據OIE對Q熱診斷方法,建議以酵素結合免疫吸附試驗 (ELISA)
套組應用於大規模牛羊草食動物的Q熱血清抗體調查,有效且迅速瞭解Q熱感染概況,配合聚合酶鏈反應(PCR)的技術如Trans-PCR可以檢查出小量的病原核酸存在,陽性場每年建議進行至少一次血清學監測,以瞭解本病的消長,並做為擬定Q熱防治措施之參考依據。此外,針對非牛羊動物,則建議可使用如間接螢光抗體(IFA)試驗和補體結合(CF)試驗等進行血清學監測或感染動物乳汁之乳清中抗體檢查。一般Q熱血清反應因菌株特異抗體出現在早期,而共同抗體稍後才出現,因此需採取發病初期、回復初期(第三週)和回復後期(第五週後)三次血樣進行診斷較佳。
- PCR病原核酸診斷- 為避免污染實驗室及感染檢驗人員,胎盤或乳汁等組織可先加入福馬林不活化病原後再萃取DNA,引子可依Houver、Stein與Raoult等人(1992)由Transposon-like
element 設計之Trans-PCR,Trans1(TAT GTA TCC ACC GTA GCC AGT)與Trans2 (CCC AAC AAC
ACC TCC TTA TTC),預期PCR產物為687 bp;或Zhang等人 (1998) 設計的 nested PCR使用OMP1(AGT AGA
AGC ATC CCA AGC ATT G),OMP2 (TGC CTG CTA GCT GTA ACG ATT G),OMP3(GAA GCG CAA
CAA GAA GAA CAC)及OMP4(TTG GAA GTT ATC ACG CAG TTG)等兩對引子,預期PCR產物分別為501與438 bp,進行DNA增幅後定序分析。
八、國外的Q熱防治經驗
在荷蘭,Q熱已存多年,過去,每年約有 20人感染Q熱,2007年起Q熱感染確診病例數突然增加至每年
170人,2008年迅速提升至1000例,2009年有超過2300個確診感染Q熱病例並且導致6人死亡,2007年荷蘭經確認因羊群大規模爆發感染Q熱後引發人感染病例增加,因此呈報OIE並積極研擬Q熱防治措施。初期採取全面撲殺感染的懷孕母羊
(統計約撲殺了50,000頭),禁止陽性場種公羊配種,並進行移動管制,然而撲殺陽性羊群並無法控制疫情,2009年人的感染病例仍增加至2,300例。2009年起採取強制疫苗免疫,使用法國生產的疫苗
(vaccine produced by CEVA; CEVA Santé Animale, Libourne,
France),提供包括山羊與綿羊繁殖場、乳羊場、乳牛場、動物園、生態農場等強制免疫,動物Q熱監測計畫於高峰期由每週定期監測至目前改為每月監測一次,感染場牛/羊奶監測則為兩週一次,未感染場牛/羊奶監測每月一次。此外,同時進行堆肥中Q熱病原檢測,採集中處理堆肥,以避免經由堆肥傳播本病,結果顯示已可有效控制Q熱病原的環境污染,後序的產仔高峰期即未見人類的病例被報告,顯示羊群強制使用疫苗並進行堆肥集中處理,可有效降低人的感染病例數。
歐盟認為利用接種疫苗控制動物Q熱,應被視為一項長期控制Q熱的方法,利用抗生素治療動物則不建議。預防接種、適當的糞便廄肥管理、剪羊毛管理、隔離產羔/仔區、移除危害物質和禁止遊客;在產羔/仔期間,控制人類和小反芻動物之間的距離,有助於減少Q熱從動物群中蔓延到人類;加強宣導讓農民和獸醫瞭解Q熱的風險因子,均為重要的Q熱散播防控方法。短期的控制方案,例如撲殺懷孕動物、暫時禁止繁殖、撲殺陽性動物、隔離、動物移動管制等均可降低感染動物排菌,進而降低人類暴露於污染的環境。
澳洲農業部則採取定期監測與調查,針對畜牧產業推動動物生物安全(Animal Biosecurity),防止牧場、動物與人三者間接觸引起人畜間疾病共通或疫病漫延等問題,並使用疫苗控制Q熱疫情。
斯洛伐克 (Slovakia) 在1970~1980年代,於牛隻使用phase I C. burnetii
不活化Q熱疫苗免疫,污染地區犢牛於6個月齡時以不活化之C. burnetii菌苗免疫接種,抗體可持續20個月以上,第二次補強接種抗體力價可產生極顯著之增加,接種免疫可減少發病率並顯著減少排菌量和降低流產率,此舉已有效控制疫情,並為OIE與許多科學期刊報告引用。
九、防治Q熱應加強推動動物生物安全防疫措施
台灣地狹人稠,牛、羊場與住家及人群活動藩籬無法界定。我們自2004年發現一肉羊場由台中縣與屏東縣各引進一批羊群後,場內原本無流產病史,於動物引進半年後開始出現流產病例,高峰期流產率達60%以上。為控制Q熱引發流產問題,我們曾由Q熱陽性羊場,依據Q熱建議用藥與劑量以OTC進行全場治療,結果顯示單獨使用OTC無法控制本病。由於本菌在pH
4.5 phagolysosome中可大量複製,文獻指出,其需合併使用如 quinolone類或chloroquine類具有鹼化細胞內環境的藥物,促使細胞吞噬-溶小體
(phagolysosome)內環境鹼化,降低其大量複製,藥物方可有效的作用。目前,現場利用淘汰異常流產的母畜,可降低環境中的病原量。對於乳牛而言,乾乳期給藥或許可解決部份流產問題,但無法完全治癒,建議畜主主動進行例行性Q熱監測,對於具繁殖障礙的患畜可屠宰淘汰,妥善處理母畜生產過程產生的廢棄物如胎盤組織等,並予焚燬處理,可降低環境中的病原量。由於罹患本病的母羊其一公克的胎盤組織中含有高達109菌量,每公克乳汁中含有105菌量,因此:
- 生物安全:加強宣導動物生物安全對維護農場動物、人、畜主及家人健康的重要性。
- 危險因子:由於罹患本病的母羊其一公克的胎盤組織中含有高達109菌量,每公克乳汁中含有105菌量,因此,畜主應妥善處理母畜生產過程產生的胎盤、胎膜、絨毛尿囊液等體液、污染物品及流死產胎兒等,最好經過適當的包裝後以高壓滅菌或直接焚燬處理,並加強環境消毒。
- 乳汁利用巴斯德滅菌法可除去感染性病原。
-
隔離檢疫:農場欲引進新動物時,應先進行Q熱檢測,確定引進無潛在感染之虞的動物,且必需進行隔離檢疫。血清學反應因菌株特異抗體出現在早期而共同抗體稍後才出現,因此需採取發病初期、回復初期(第三週)和回復後期(第五週後)三次血樣進行血清抗體檢測。
- 加強篩檢:利用ELISA血清學監測、PCR、nested PCR檢出病原,淘汰陽性繁殖障礙患畜
(屠宰),陽性牧場需每年定期血清學監測,加強宣導,避免高污染場具有繁殖障礙的牛羊淘汰後再度進入活體動物買賣市場。
- 若必需以投藥控制,高污染場利用懷孕最後一個月投藥治療可降低病原量,利用四環黴素類或紅黴素併用quinolone類或chloroquine類具有鹼化細胞內環境的藥物
(因本菌於pH 4.5 phagolysosome中可大量複製,文獻指出,需合併使用可使細胞內環境鹼化的藥物,可降低其大量複製)。
- 加強環境消毒與廄肥處理:環境可使用10%漂白水、10%H2O2 或5-10%來蘇(Lysol)消毒,建築設備與環境等可用5%漂白水、5%
H2O2、5%來蘇(Lysol)或多聚甲醛 (Paraformaldehyde)煙燻消毒,廄肥以焚燬處理。
|
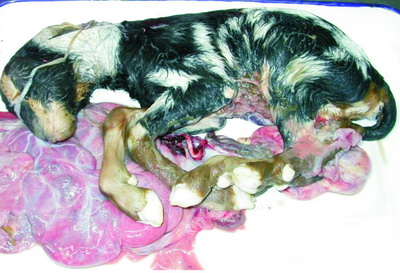
圖1. 伯納特科克斯氏體感染引發死產胎兒及胎盤組織。 |

圖2. 流死產胎兒肺臟組織肉眼病變具有多發性暗紅色斑點,觸摸呈實質化。 |
|

圖3. 胎盤絨毛尿囊膜子葉暗紅色壞死,表面具有帶血紅色混濁液體。 |

圖4. 部份胎盤組織具有黃白色壞死灶。 |
|
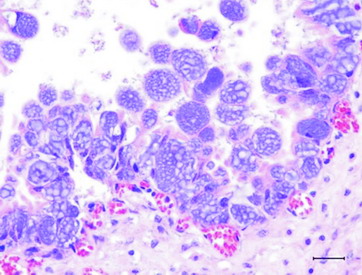
圖5. 絨毛尿囊膜之上皮細胞擴大,細胞質中充滿大小約1 μm嗜鹼性菌體。H&E 400X。 |

圖6. 經Machiavello’s 染色法,胎盤滋養細胞質中的菌體呈現紅染。Bar=25μ。 |
參考文獻
- 劉振軒 邱慧英 張文發 林滄龍。甲、乙、丙類動物傳染病之簡介。臺灣養豬科學研究所。1998,1999。
- Abe, T., Yamaki, K., Hayakawa, T., Fukuda, H., Ito, Y., Kume, H.,
Komiya, T., Ishihara, K., Hirai, K., 2001, A seroepidemiological study of
the risks of Q fever infection in Japanese veterinarians. Eur J Epidemiol
17, 1029-1032.
- Bazlikova, M., Kazar, J., Schramek, S., 1984, Phagocytosis of Coxiella
burnetii by Hyalomma dromedarii tick haemocytes. Acta Virol 28, 48-52.
- Bossi, P., Guihot, A., Bricaire, F., 2003, [Q fever, a potential
biowarfare agent]. Presse Med 32, 1618-1621.
- Carley, J.G., Pope, J.H., 1953, The isolation of Coxiella burneti from
the tick Ixodes holocyclus in Queensland. Aust J Exp Biol Med Sci 31,
613-614.
- Chen, H.L., Chen, H.Y., Wu, Y.C., Horng, C.B., 1994, Q fever in Taiwan.
Zhonghua Yi Xue Za Zhi (Taipei) 54, 1-6.
- Gillespie, J.H., Baker, J.A., 1952, Experimental Q fever in cats. Am J
Vet Res 13, 91-94.
- Inoue, N., 2003, [Germs and toxins in bioterrorism]. Nippon Rinsho 61
Suppl 2, 81-91.
- Juncker-Voss, M., Prosl, H., Lussy, H., Enzenberg, U., Auer, H., Lassnig,
H., Muller, M., Nowotny, N., 2004, [Screening for antibodies against
zoonotic agents among employees of the Zoological Garden of Vienna,
Schonbrunn, Austria]. Berl Munch Tierarztl Wochenschr 117, 404-409.
- Kagawa, F.T., Wehner, J.H., Mohindra, V., 2003, Q fever as a biological
weapon. Semin Respir Infect 18, 183-195.
- Marmion, B.P., Storm, P.A., Ayres, J.G., Semendric, L., Mathews, L.,
Winslow, W., Turra, M., Harris, R.J., 2005, Long-term persistence of
Coxiella burnetii after acute primary Q fever. Qjm 98, 7-20.
- Rehacek, J., Urvolgyi, J., Kocianova, E., Sekeyova, Z., Vavrekova, M.,
Kovacova, E., 1991, Extensive examination of different tick species for
infestation with Coxiella burnetii in Slovakia. Eur J Epidemiol 7, 299-303.
- Shaw, E.I., Moura, H., Woolfitt, A.R., Ospina, M., Thompson, H.A., Barr,
J.R., 2004, Identification of biomarkers of whole Coxiella burnetii phase I
by MALDI-TOF mass spectrometry. Anal Chem 76, 4017-4022.
- Stephen, S., Achyutha Rao, K.N., 1979, Q fever in South Kanara district:
natural occurrence of Coxiella burnetii in the tick (Aponomma gervaisi)--preliminary
report. Indian J Med Res 69, 244-246.
- Wu, C.S., Chang, K.Y., Lee, C.S., Chen, T.J., 1995, Acute Q fever
hepatitis in Taiwan. J Gastroenterol Hepatol 10, 112-115.
- Yadav, M.P., Rarotra, J.R., Sethi, M.S., 1979, The occurence of
coxiellosis among rodents and shrews in the Tarai area of Uttar Praedesh. J
Wildl Dis 15, 11-14.
- Yadav, M.P., Sethi, M.S., 1980, A study on the reservoir status of
Q-fever in avifauna, wild mammals and poikilotherms in Uttar Pradesh
(India). Int J Zoonoses 7, 85-89.
- Zhang, G., To, H., Russell, K.E., Hendrix, L.R., Yamaguchi, T., Fukushi,
H., Hirai, K., Samuel, J.E., 2005, Identification and characterization of an
immunodominant 28-kilodalton Coxiella burnetii outer membrane protein
specific to isolates associated with acute disease. Infect Immun 73,
1561-1567.
[回上頁 | 顯示此文件為可列印格式]
此文件提供者: shuYing - [評分 : 0.00 (0 票選) | 評分!]
|
|
|